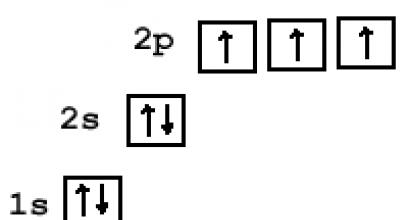
Химия. Схема строения атома: ядро, электронная оболочка. Примеры Электронно графическая схема фтора
Алгоритм составления электронной формулы элемента:
1. Определите число электронов в атоме используя Периодическую таблицу химических элементов Д.И. Менделеева .
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей :
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором - максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем - максимум 18 (два s , шесть p , и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s- подуровень, затем р-, d- b f- подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Примеры.
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.

2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
1s 2 2s 2 2p 6 3s 2 3p 6 .

3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5

Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 - это электронная формула аргона.
Электронную формулу цинка можно представить в виде.
Электронные конфигурации атомов
Общее число электронов в атоме определяется зарядом его ядра, т. е. протонным числом. Оно равно атомному номеру элемента. Электроны в зависимости от их энергии распределяются в атоме по энергетическим уровням и подуровням, каждый из которых состоит из определенного числа орбиталей.
Распределение электронов выражается с помощью электронных формул (или электронных конфигураций) атома. Например, у водорода, элемента с атомным номером 1, электронная формула: 1Н 1s1. В этой формуле цифрой записывается номер энергетического уровня, затем следует буква, обозначающая тип подуровня, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы, в которой орбитали представляются в виде клеток, а электроны - в виде стрелок.
Электронно-графическая схема атома водорода записывается так:
Для правильного изображения электронных формул необходимо соблюдать несколько основных правил.
1-е правило: Распределение электронов в атоме, находящемся в основном (наиболее устойчивом) состоянии, определяется принципом минимума энергии: основному состоянию атома соответствуют наиболее низкие из возможных энергетические уровни и подуровни.
Поэтому электроны (у атомов элементов первых трех периодов) заполняют орбитали в порядке увеличения их энергии:
1s→2s→2p→3s→3p
2-е правило: На каждой орбитали максимально может находиться не более двух электронов, причем с противоположными спинами.
Таким образом, у следующего за водородом гелия 2Не электронная формула:
2Не 1s2 ,
Поскольку на первом электронном слое могут находиться только два электрона, то этот слой в атоме гелия является завершенным и, следовательно, очень устойчивым.
У атомов элементов второго периода заполняется второй энергетический уровень, на котором может находиться не более 8 электронов. Сначала электроны заполняют 2s-орбиталь (у атомов лития и бериллия):

Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора В занимает одну из трех 2p-орбиталей. Электронная формула атома бора:
а электронно-графическая схема:

Обратите внимание, что подуровень 2p изображен вплотную к подуровню 2s, но несколько выше. Так подчеркивается его принадлежность к одному и тому же уровню (второму) и одновременно больший запас энергии.
3-е правило. Устанавливает порядок заполнения орбиталей одного подуровня. Электроны одного подуровня сначала заполняют орбитали по одному (т. е. все пустые), а если число электронов больше, чем число орбиталей, то по два. Следовательно, электронные формулы атомов углерода и азота:
6C 1s22s22p2 и 7N 1s22s22p3
а электронно-графические схемы:

У атомов кислорода, фтора и неона число электронов увеличивается, и они вынуждены размещаться на р-орбиталях второго энергетического уровня по два:
6O 1s22s22p4; 6F 1s22s22p5; 6Ne 1s22s22p6
Электронно-графические схемы атомов этих элементов:

Электронная конфигурация внешнего слоя 2s22p6 соответствует его полному заполнению и поэтому является устойчивой.
В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами s-подуровень у натрия и магния:
11Na 1s22s22p63s1 12Mg 1s22s22p63s2
а затем р-подуровень у алюминия, кремния, хлора и аргона:
18Ar 1s22s22p63s23p6
Электронно-графическая схема для атома аргона:

В атоме аргона на внешнем электронном слое находится 8 электронов. Следовательно, он завершен, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более 8 электронов.
Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой 2n2 на нем может находиться 18 электронов: 8 на s- и р-подуровнях и 10 - на d-подуровне. Этот подуровень будет формироваться у элементов четвертого периода. Но сначала у первых двух элементов четвертого периода - калия и кальция - появляется четвертый электронный слой, который открывается s-подуровнем (энергия подуровня 4s несколько меньше, чем подуровня 3d:
19K 1s22s22p63s23p64s1 и 19Са 1s22s22p63s23p64s2
Только после этого начнет заполняться электронами d-подуровень третьего, теперь уже предвнешнего, энергетического уровня. Электронная конфигурация атома скандия:
21Sc 1s22s22p63s23p64s23d1,
атома титана:
21Ti 1s22s22p63s23p64s23d2,
и т. д., вплоть до цинка. Электронная конфигурация его атома:
21Zn 1s22s22p63s23p64s23d10,
а электронно-графическая схема:

Поскольку у элементов четвертого периода заполняются электронами только орбитали третьего и четвертого энергетических уровней, то на электронно-графических схемах обычно не указывают полностью заполненные уровни (в данном случае первый и второй). Вместо них в электронных формулах пишут символ ближайшего элемента VIII A-группы с полностью заполненными энергетическими s- и р-подуровнями: например, электронная формула хлора - 3s23p5, цинка - 3d104s2, а сурьмы - 51Sb -4d105s25p3
Кроме электронных формул и электронно-графических схем, иногда используют и электронные схемы атомов, в которых указывают только число электронов на каждом энергетическом уровне (электронном слое):
Электронное строение атома определяется зарядом его ядра, который равен атомному номеру элемента в периодической системе.
Распределение электронов по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных формул и электронно-графических схем, а также электронных схем атомов.
На внешнем электронном слое в атоме любого элемента может находиться не более 8 электронов. 3.2. Типы химических связей
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма , когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму , если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1 .
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χ A – χ B) + 3,5(χ A – χ B) 2 , где χ A и χ B – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже (см. метод валентных связей ).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+ Cl 0,8– .
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь . Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1 . Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H 2 O, H 2 F 2 , NH 3 . За счет водородных связей вода характеризуется столь высокими по сравнению с H 2 Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль –1 .
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl t пл. = 801 °C, а для NaNO 3 t пл = 306,5 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией АО. Она была введена для объяснения того факта, что двухэлектронные двухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Так, Be*(2s 1 1p 1), B*(2s 1 2p 2), C*(2s 1 2p 3) образуют за счет s- и p-орбиталей соответственно две, три и четыре связи, а потому одна из них должна быть прочнее других. Однако опыт показывает, что в BeH 2 , BCl 3 , CH 4 все связи равноценны. У BeH 2 угол связи равен 180°, у BCl 3 – 120°, а у CH 4 – 109°28".
Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией). Так s- и p-орбитали дают две sp-ГО, расположенные под углом 180° друг относительно друга.
В молекуле CH 4 гибридные орбитали из четырех АО углерода (одной s и трех p), называются sp 3 -орбиталями, они полностью эквивалентны энергетически и пространственно направлены к вершинам тетраэдра.
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей.
Число гибридных орбиталей равно числу АО, участвующих в гибридизации.
Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты.
В гибридизации участвуют АО, имеющие общие признаки симметрии.
Согласно табл. 3.3 гибридные орбитали дают молекулы с углами 180°, 120°, 109°28", 90°. Это правильные геометрические фигуры. Такие молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
H–Be–H, HC≡CH
H 2 C=CH 2 , C 6 H 6 , BCl 3
|
|
|
тетраэдрическая |
CH 4 , CCl 4 , H 3 C–CH 3
d 2 sp 3 или sp 3 d 2
В качестве примера рассмотрим молекулы NH 3 и H 2 O. Атомы азота и кислорода склонны к sp 3 -гибридизации. У азота на sp 3 -ГО, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Именно она, занимая одну sp 3 -ГО, искажает угол связи H–N–H до 107,3°. В молекуле H 2 O таких несвязывающих пар две, и угол H–O–H равен 104,5° (рис. 3.17).
Электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Чем сильнее межэлектронное отталкивание, тем больше условная поверхность на сфере, занимаемый электронной парой. Для качественного объяснения экспериментальных фактов обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательности периферийных атомов (метод Гиллеспи ).
Физические свойства металлов.
Плотность. Это - одна из важнейших характеристик металлов и сплавов. по плотности металлы делятся на следующие группы:
легкие (плотность не более 5 г/см 3) - магний, алюминий, титан и др.:
тяжелые - (плотность от 5 до 10 г/см 3) - железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
очень тяжелые (плотность более 10 г/см 3) - молибден, вольфрам, золото, свинец и др.
В таблице 2 приведен значения плотности металлов. (Это и последующие таблицы характеризуют свойства тех металлов, которые составляют основу сплавов для художественного литья).
Таблица 2. Плотность металла.
Температура плавления. В зависимости от температуры плавления металл подразделяют на следующие группы:
легкоплавкие (температура плавления не превышает 600 o С) - цинк, олово, свинец, висмут и др.;
среднеплавкие (от 600 o С до 1600 o С) - к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
тугоплавкие (более 1600 o С) - вольфрам, молибден, титан, хром и др.
Ртуть относится к жидкостям.
При изготовлении художественных отливок температура плавления металла или сплава определяет выбор плавильного агрегата и огнеупорного формовочного материала. При введении в металл добавок температура плавления, как правило, понижается.
Таблица 3. Температура плавления и кипения металлов.
|
Металл |
Температура, oС |
Металл |
Температура, oС |
||
|
плавления |
кипения |
плавления |
кипения |
||
|
Алюминий |
|||||
Удельная теплоемкость. Это количество энергии, необходимое для повышения температуры единицы массы на один градус. Удельная теплоемкость уменьшается с увеличением порядкового номера элемента в таблице Менделеева. Зависимость удельной теплоемкости элемента в твердом состоянии от атомной массы описывается приближенно законом Дюлонга и Пти:
m a c m = 6.
где, m a - атомная масса; c m - удельная теплоемкость (Дж/кг * o С).
В таблице 4 приведены значения удельной теплоемкости некоторых металлов.
Таблица 4. Удельная теплоемкость металлов.
|
Металл |
Температура, o С |
o С |
Металл |
Температура, o С |
Удельная теплоемкость, Дж/кг * o С |
|
Алюминий |
|||||
2. Строение ядер и электронных оболочек атомов
2.7. Распределение электронов в атоме
Состояние электронов в атоме указывают, используя определенную форму записи. Например, для атома гелия имеем:
Распределение электронов в атоме указывают с помощью:
а) электронных схем , в которых отмечено только число электронов на каждом слое. Например: Mg 2e , 8e , 2e ; Cl 2e , 8e , 7e .
Часто употребляют графические электронные схемы, например, для атома хлора:

б) электронных конфигураций
; в этом случае показаны номер слоя (уровня), природа подуровней и число электронов на них. Например:
Mg 1s
2 2s
2 2p
6 3s
2 ;
в) электронно-графических схем , на которых орбитали изображают, например, в виде клетки, а электроны - стрелками (рис. 2.6).

Рис. 2.6. Электронно-графическая схема для атома магния
Кроме полных формул электронных конфигураций, широко используются сокращенные. В этом случае часть электронной конфигурации, соответствующая благородному газу, указывается символом благородного газа в квадратных скобках. Например: 12 Mg3s 2 , 19 K4s 1 .
Существуют определенные принципы и правила заполнения электронами энергетических уровней и подуровней:
1. Принцип минимума полной энергии атома, согласно которому заселение электронами АО происходит так, чтобы полная энергия атома была минимальной. Экспериментально установлена следующая последовательность заполнения АО:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p ... .
2. На одной АО может находиться не более двух электронов, причем их спины в этом случае должны быть антипараллельными.
3. В пределах данного энергетического подуровня электроны заполняют АО постепенно, вначале по одному (сначала все вакантные, а уже затем - по два), причем ориентация всех неспаренных электронов должна быть одинаковой, т.е. такой
но не такой
Практически в любом атоме внешними являются только s - и p -АО (рис. 2.7), поэтому на внешнем электронном слое любого атома не может находиться более восьми электронов . Внешний электронный слой, содержащий восемь электронов (в случае гелия - два) называется завершенным .

Рис. 2.7. Электронно-графические схемы для атомов K (а ) и S (б )
Электронные конфигурации атомов элементов 4-го периода периодической системыЗначения энергий разных энергетических подуровней для различных атомов не являются постоянными, а зависят от заряда ядра Z атома элемента: для атомов элементов с Z = 1–20 Е 3 d > E 4 s и Е 3 d > E 4 p ; для атомов элементов с Z ≥ 21 наоборот: Е 3 d < E 4 s и Е 3 d < E 4 p (рис. 2.8). Кроме того, чем больше Z , тем меньше различаются подуровни по энергии, а кривые, выражающие зависимость энергии подуровней от Z , пересекаются.

Рис. 2.8. Диаграмма энергетических подуровней атомов элементов с Z = 1–20 (а ), Z ≥ 21 (б )
Электронные конфигурации атомов (основное состояние) K и Са следующие (см. рис. 2.8):
19 K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ,
20 Ca: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
Начиная со скандия (Z = 21) заполняется 3d -подуровень, а во внешнем слое остаются 4s -электроны. Общая электронная формула атомов элементов от Sс до Zn - 3d 1−10 4s 1−2 . Например:
21 Sс: 3d 1 4s 2 ,
25 Mn: 3d 5 4s 2 ,
28 Ni: 3d 8 4s 2 .
30 Zn: 3d 10 4s 2 .
Для хрома и меди наблюдается проскок (провал) 4s -электрона на 3d -подуровень: Cr - 3d 5 4s 1 , Cu - 3d 10 4s 1 . Такой проскок с ns - на (n − 1)d -подуровень наблюдается также у атомов других элементов (Mo, Ag, Au, Pt) и объясняется близостью энергий ns - и (n − 1)d -подуровней, а также стабильностью наполовину и полностью заполненных d -подуровней.
Дальше в 4-м периоде после 10 d -элементов следуют от Ga ( 3d 10 4s 2 4p 1) до Kr ( 3d 10 4s 2 4p 6) p -элементы.
Образование катионов d -элементов связано с потерей сначала внешних ns -, затем (n − 1)d -электронов, например:
Ti: 3d 2 4s 2 → − 2 e − Ti 2+ : 3d 2 → − 1 e − Ti 3+ : 3d 1
Mn: 3d 5 4s 2 → − 2 e − Mn 2+ : 3d 5 → − 2 e − Mn 4+ : 3d 3
Отметим, что в формулах электронных конфигураций принято записывать сначала все электроны с меньшим значением n , а затем переходить к указанию электронов с более высоким значением главного квантового числа. Поэтому порядок заполнения и порядок записи энергетических подуровней для 3d -элементов не совпадают. Например, в электронной формуле атома скандия 3d -орбиталь указана до 4s -орбитали, хотя раньше заполняется 4s -орбиталь.
Возникает закономерный вопрос: почему в атомах 3d -элементов раньше заполняется 4s -подуровень, хотя его энергия больше энергии 3d -подуровня? Почему, например, атом Sc не имеет в основном состоянии электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 ?
Это происходит потому, что соотношение энергий различных электронных состояний атома не всегда совпадает с соотношением энергий отдельных энергетических подуровней. Энергия 4s
-подуровня для 3d
-элементов больше энергии 3d
-подуровня, но энергия состояния
3d
1 4s
2 меньше энергии состояния 3d
3 .
Объясняется это тем, что межэлектронное отталкивание, а соответственно и энергия всего состояния для конфигурации...3d 3 (с тремя электронами на одном и том же энергетическом подуровне) больше, чем для конфигурации...3d 1 4s 2 (с тремя электронами, находящимися на разных энергетических уровнях).
Инструкция
Электроны в атоме занимают свободные орбитали в последовательности, называемой шкалой :1s / 2s, 2p / 3s, 3p / 4s, 3d, 4p / 5s, 4d, 5p / 6s, 4d, 5d, 6p / 7s, 5f, 6d, 7p. На орбитали могут располагаться два электрона с противоположными спинами – направлениями вращения.
Структуру электронных оболочек выражают с помощью графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один или два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.
Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните последовательно 1s, 2s, 2p, 3s, 3p, 4s уровни, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти уровни заполнены полностью.

У вас осталось еще пять электронов и незаполненный 3d-уровень. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.

Электронно-графические формулы наглядно показывают количество неспаренных электронов, которые определяют валентность.
Обратите внимание
Помните, что химия – наука исключений. У атомов побочных подгрупп Периодической системы встречается «проскок» электрона. Например, у хрома с порядковым номером 24 один из электронов с 4s-уровня переходит в ячейку d-уровня. Похожий эффект есть у молибдена, ниобия и др. Кроме того, есть понятие возбужденного состояния атома, когда спаренные электроны распариваются и переходят на соседние орбитали. Поэтому при составлении электронно-графических формул элементов пятого и последующих периодов побочной подгруппы сверяйтесь со справочником.
Источники:
- как составить электронную формулу химического элемента
Электроны входят в состав атомов. А сложные вещества, в свою очередь, из этих атомов состоят (атомы образуют элементы) и электроны между собой делят. Степень окисления показывает, какой атом сколько электронов себе забрал, а какой сколько отдал. Этот показатель можно определить.

Вам понадобится
- Школьный учебник по химии 8-9 класс любого автора, таблица Менделеева, таблица электроотрицательности элементов (печатаются в школьных учебниках по химии).
Инструкция
Для начала необходимо обозначить, что степень - это понятие , принимающее связи за , то есть не углубляющиеся в строение. Если элемент находится в свободном состоянии, то это самый простой случай - образуется простое вещество, а значит степень окисления его равна нулю. Так например, водород, кислород, азот, фтор и т.д.
В сложных веществах все обстоит иначе: электроны между атомами распределены неравномерно, и именно степень окисления помогает определить количество отданных или принятых электронов. Степень окисления может положительной и отрицательной. При плюсе электроны отдаются, при минусе принимаются. Некоторые элементы свою степень окисления сохраняют в различных соединениях, но многие этой особенностью не отличаются. Нужно помнить немаловажное правило - сумма степеней окисления всегда равна нулю. Простейший пример, газ СО: зная, что степень окисления кислорода в преобладающем большинстве случаев равна -2 и используя вышеобозначенное правило, можно вычислить степень окисления для С. В сумме с -2 ноль дает только +2, а значит степень окисления углерода +2. Усложним задачу и возьмем для вычислений газ СО2: степень окисления кислорода по-прежнему остается -2, но молекул его в данном случае две. Следовательно, (-2) * 2 = (-4). Число, в сумме с -4 дающее ноль, +4, то есть в этом газе имеет степень окисления +4. Пример посложнее: Н2SO4 - у водорода степень окисления +1, у кислорода -2. Во взятом соединении 2 молекулы водорода и 4 кислорода, т.е. заряды будут, соответственно, +2 и -8. Для того чтобы в сумме получить ноль, нужно добавить 6 плюсов. Значит, степень окисления серы +6.
Когда в соединении сложно определить, где плюс, где минус, необходима таблица электроотрицательности (ее несложно найти в учебнике по общей химии). Металлы часто имеют положительную степень окисления, а неметаллы отрицательную. Но например, PI3 - оба элемента неметаллы. В таблице указано, что электроотрицательность йода равна 2,6, а фосфора 2,2. При сравнении выясняется, что 2,6 больше, чем 2,2, то есть электроны стягиваются в сторону йода (йод имеет отрицательную степень окисления). Следуя приведенным несложным примерам, можно легко определить степень окисления любого элемента в соединениях.
Обратите внимание
Не нужно путать металлы и неметаллы, тогда степень окисления будет проще найти и не запутаться.
Атом химического элемента состоит из ядра и электронной оболочки. Ядро - это центральная часть атома, в котором сосредоточена почти вся его масса. В отличие от электронной оболочки, ядро имеет положительный заряд.

Вам понадобится
- Атомный номер химического элемента, закон Мозли
Инструкция
Таким образом, заряд ядра равен количеству протонов. В свою очередь, количество протонов в ядре равно атомному номеру . К примеру, атомный номер водорода - 1, то есть ядро водорода состоит из одного протона имеет заряд +1. Атомный номер натрия - 11, заряд его ядра равен +11.
При альфа-распаде ядра его его атомный номер уменьшается на два за счет испускания альфа-частицы (ядра атома ). Таким образом, количество протонов в ядре, испытавшем альфа-распад, также уменьшается на два.
Бета-распад может происходить в трех различных видах. В случае распада «бета-минус» нейтрон превращается в протон при испускании электрона и антинейтрино. Тогда заряд ядра увеличивается на единицу.
В случае распада «бета-плюс» протон превращается в нейтрон, позитрон и нйтрино, заряд ядра уменьшается на единицу.
В случае электронного захвата заряд ядра также уменьшается на единицу.
Заряд ядра можно также определить по частоте спектральных линий характеристического излучения атома. Согласно закону Мозли: sqrt(v/R) = (Z-S)/n, где v - спектральная частота характеристического излучения, R - постоянная Ридберга, S - постоянная экранирования, n - главное квантовое число.
Таким образом, Z = n*sqrt(v/r)+s.
Видео по теме
Источники:
- как изменяется заряд ядра
При создании теоретических и практических работ по математике, физике, химии студент или школьник сталкивается с необходимостью вставки специальных символов и сложных формул. Располагая приложением Word из офисного пакета Microsoft, можно набрать электронную формулу любой сложности.

Инструкция
Перейдите на вкладку «Вставка». Справа найдите π, а рядом надпись «Формула». Нажмите на стрелочку. Появится окно, в котором вы можете выбрать встроенную формулу, например, формулу квадратного уравнения.
Нажмите на стрелку и на верхней панели появятся самые разные символы, которые вам могут понадобиться при написании конкретно этой формулы. Изменив ее так, как нужно вам, вы можете сохранить ее. С этого момента она будет выпадать в списке встроенных формул.
Если вам нужно перенести формулу в , который позже нужно разместить на сайте, то кликните на активном поле с ней правой кнопкой мыши и выберите не профессиональный, а линейный способ . В частности, все того же квадратного уравнения в данном случае примет вид:x=(-b±√(b^2-4ac))/2a.
Другой вариант написания электронной формулы в Word – через конструктор. Зажмите одновременно клавиши Alt и =. У вас сразу появится поле для написания формулы, а в верхней панели откроется конструктор. Здесь вы можете выбрать все знаки, которые могут понадобиться для записи уравнения и решения любой задачи.
Некоторые символы линейной записи могут быть непонятными читателю, незнакомому с компьютерной символикой. В этом случае самые сложные формулы или уравнения имеет смысл сохранить в графическом виде. Для этого откройте самый простой графический редактор Paint: «Пуск» - «Программы» - «Paint». Затем увеличьте масштаб документа с формулой так, чтобы она заняла весь экран. Это необходимо, чтобы сохраненное изображение имело наибольшее разрешение. Нажмите на клавиатуре PrtScr, перейдите в Paint и нажмите Ctrl+V.